Contenido
EQUIVALENTE
MECÁNICA DEL CALOR
Problemas
y ejercicios resueltos de calorimetría (videos)
Problemas
ejercicios resueltos calor latente de fusión (videos)
Problemas
y ejercicios resueltos de calor latente de vaporización (videos)
Problemas
y ejercicios resueltos grafica temperatura vs calor (videos)
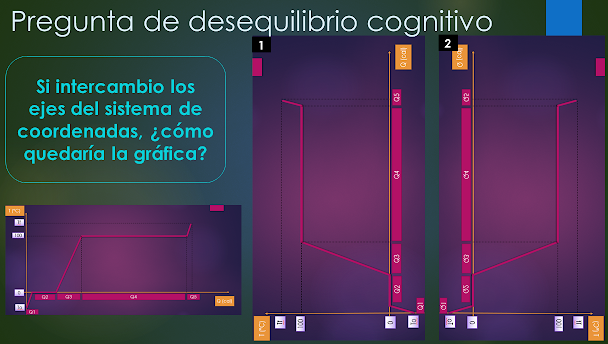
Preguntas
de desequilibrio cognitivo
CALORIMETRÍA
Es importante comprender que temperatura y calor no
significan los mismo. A continuación explicaremos la definición de cada una.
TEMPERATURA
Es una cantidad física escalar que permite comparar la
energía interna en promedio (energía cinética de las partículas de un cuerpo)
entre dos o más cuerpos o sustancias.
CALOR
Es la transferencia de energía que se produce desde un
cuerpo de temperatura alta hacia un cuerpo de temperatura baja. Es energía en
transición.
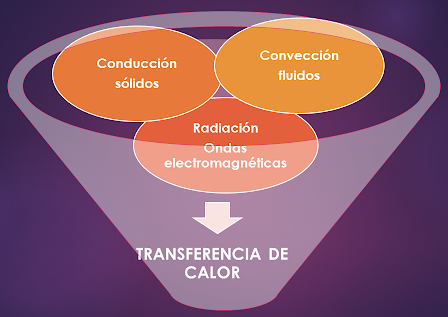
Existen 3 formas de transferir calor: conducción,
convección y radiación.
CONDUCCIÓN
Es el paso de la energía a través de sólidos.
CONVECCIÓN
Es el paso de la energía a través de fluidos (líquidos,
gases).
RADIACIÓN
Es la transmisión de energía a través de ondas
electromagnéticas, como por ejemplo la energía que llega desde el sol hacia los
planetas.
CALOR ESPECÍFICO
Es la cantidad de calor que necesita cada gramo de
sustancia para variar su temperatura 1 °C. Además, es una medida de la inercia
térmica
INERCIA TÉRMICA
Es la capacidad que tiene un cuerpo de mantener su
temperatura y depende del calor específico. Es decir que mientras más alto es
el calor específico de un cuerpo, más difícil será calentarlo o enfriarlo, es
decir más inercia térmica tendrá.
EQUIVALENTE MECÁNICA DEL CALOR
Nos dice que 1 caloría equivale a 4,18 Joules
A continuación, damos los valores del calor específico del
agua, hielo y vapor de agua:
Desafío calorimetría, desequilibrio cognitivo
RESPUESTA: Se debe a la gran inercia térmica que tiene el
agua, lo cual dificulta su variación de temperatura; en otras palabras, es
difícil calentar. Si comparamos su calor específico con el de los metales como
por ejemplo el cobre, es mucho mayor aproximadamente 10 veces más, es decir que
necesitaría diez veces más calorías para tener su misma variación de
temperatura.
Su elevado calor específico lo convierte en un buen
refrigerante.
La siguiente fórmula la utilizaremos para determinar la
cantidad de calor que necesita ganar un cuerpo o sustancia para elevar su
temperatura, o la cantidad de calor que pierde al disminuir su temperatura.
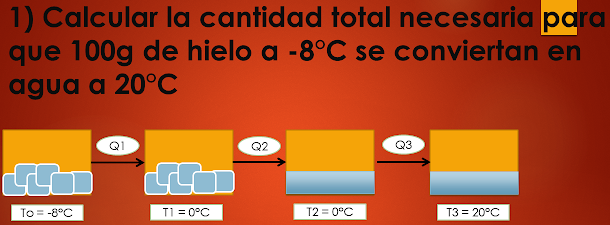
CALOR LATENTE DE FUSIÓN
FUSIÓN.-Paso del estado sólido a líquido.
SOLIDIFICACIÓN.- Paso del estado líquido a sólido
PUNTO DE FUSIÓN.- Es la temperatura a la cual un sólido se
hace líquido o viceversa. El punto de fusión del agua a nivel del mar es de
0°C.
CALOR LATENTE DE FUSIÓN.- Es la cantidad de calor que
necesita cada gramo de sustancia para cambiar de estado sólido a líquido ( si
gana calor), o de líquido a sólido (si pierde calor).
Por ejemplo, el calor latente de fusión del agua es de
80cal/g, es decir que por cada 80 cal que gana cierta masa de hielo a 0°C, se
descongela 1 gramo.
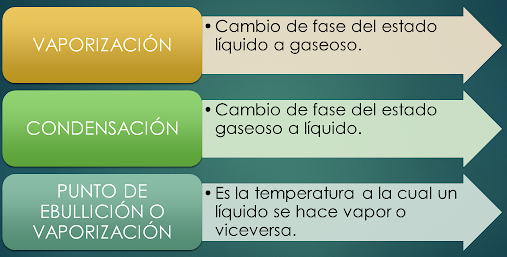
CALOR LATENTE DE VAPORIZACIÓN
VAPORIZACIÓN.- Paso del estado líquido a gaseoso.
CONDENSACIÓN.- Paso del estado gaseoso a líquido.
PUNTO DE EBULLICIÓN O VAPORIZACIÓN.- Es la temperatura a la
cual un líquido se hace vapor o viceversa. El punto de ebullición del agua a
nivel del mar es de 100°C.
CALOR LATENTE DE VAPORIZACIÓN.- Es la cantidad de calor que
necesita cada gramo de sustancia para cambiar de estado líquido a gaseoso ( si
gana calor), o de gaseoso a líquido (si pierde calor).
Por ejemplo, el calor latente de vaporización del agua es
de 540cal/g, es decir que por cada 540 cal que gana cierta masa de agua a
100°C, se evapora 1 gramo.
Pregunta desequilibrio cognitivo
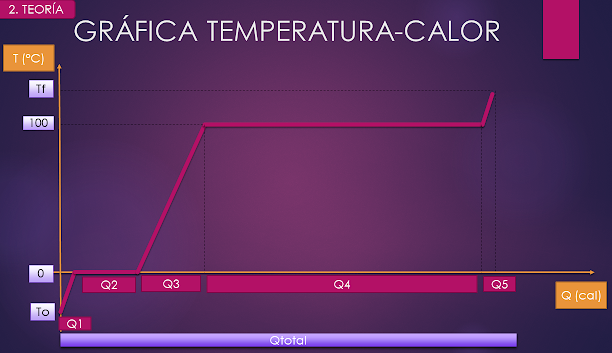
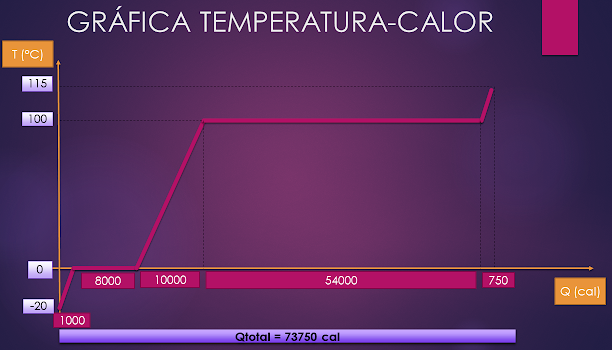
GRÁFICA TEMPERATURA - CALOR
En la gráfica temperatura-calor podemos visualizar de mejor
manera todo el proceso de cambio de fases y temperaturas.
En el eje de las abscisas (horizontal) colocaremos el
Calor, y en el eje de las ordenadas (vertical) colocaremos la Temperatura.
Observaremos que en las líneas horizontales de la gráfica
se produce un cambio de estado y no de temperatura.
























0 Comentarios